Variole du singe : causes, symptômes, diagnostic et traitement

Rédigé et vérifié par le médecin Leonardo Biolatto
La variole du singe ou virus de monkeypox est au centre des nouvelles sur la santé dans le monde entier. Mais ce n’est pas une nouvelle maladie. En réalité, des cas humains ont été signalés depuis 1970.
Le nom peut paraître déroutant et les informations qui circulent à son sujet suscitent également la polémique. Comment se transmet-elle entre humains ? Pourquoi est-elle passée de pathologie endémique au Congo à génératrice d’épidémies en Europe, en Amérique et en Australie ?
Depuis les années 1980, les cas de monkeypox se sont multipliés. Lentement mais sûrement. L’étude au niveau scientifique couvrait certaines lacunes sur le virus causal, mais de nombreux doutes subsistent.
Nous vous disons ici ce que l’on sait de la maladie et quelles sont les preuves mises à jour, dans le contexte d’une épidémie à laquelle l’Organisation mondiale de la santé (OMS) accorde une attention considérable.
Qu’est-ce que la variole du singe et comment est-elle née ?
Le monkeypox chez l’homme a été découvert pour la première fois en 1970. Le cas zéro était un enfant de la République démocratique du Congo qui avait des vésicules ressemblant à la variole mais qui ne remplissait pas toutes les conditions pour être déclaré cas de cette maladie déjà connue.
Cependant, le voyage du virus n’a pas commencé là. Le premier enregistrement scientifique qui existe de cet Orthopoxvirus concerne des primates : une épidémie chez des animaux de laboratoire a été enregistrée en 1958.
Des anticorps dirigés contre l’agent viral ont ensuite pu être isolés chez des rongeurs et des grands singes de diverses espèces vivant en Afrique. Même ainsi, l’isolement du virus en tant que tel, in vivo, n’a été possible que deux fois dans la jungle africaine.
Par conséquent, nous ne savons pas qui est le véritable réservoir, c’est-à-dire où il trouve une niche pour survivre et ensuite provoquer des épidémies. Il est alors juste de dire que nous sommes face à une zoonose.
Les zoonoses sont des maladies qui sont normalement transmises entre certains animaux, mais qui sont parfois transmises à l’homme et peuvent (ou non) suivre une voie de transmission interhumaine ultérieure.
Ce groupe d’orthopoxvirus fait partie de la famille des Poxviridae. Jusqu’à présent, il existe 4 espèces dans cette catégorie qui ont la capacité d’infecter les humains :
- Virus de la variole : c’est l’agent classique connu dans le monde entier qui a eu sa période d’action intense et a été éradiqué de plusieurs pays.
- Virus Vaccinia : c’est le virus qui a été utilisé pour le vaccin antivariolique. C’est précisément cette grande campagne mondiale de vaccination qui a conduit à la déclaration d’éradication dans diverses zones géographiques.
- Virus Cowpox : il est transmis par des animaux ruraux, mais a un comportement associé à la captivité, de sorte que des cas humains ont également été enregistrés dans des zoos et des cirques.
- Virus Monkeypox : c’est celui que nous examinons actuellement.
La transmission du virus de la variole du singe
La transmission zoonotique de cette maladie, c’est-à-dire de l’animal à l’homme, est la mieux documentée. Et les rapports que nous avons proviennent d’Afrique, où l’agent viral a été presque limité pendant des décennies.
Bien que le nom de monkeypox suggère que les primates non humains sont les principaux responsables de la transition vers notre espèce, la vérité est que la recherche pointe vers les rongeurs. Leur consommation dans les maisons rurales, la chasse pour les éradiquer en tant que ravageurs et la manipulation des rats et des écureuils semblent être le premier point de contact pour l’infection.
Dans les zones rurales d’Afrique, il a été possible d’identifier les facteurs de risque qui augmentent la probabilité que la maladie se propage aux humains. Par exemple : dormir par terre ou alimentation basée sur des rongeurs.
D’autres données ont exclu des facteurs qui pourraient être considérés comme risqués, mais qui ne le sont pas jusqu’à présent. Par exemple :
- Possession d’animaux de compagnie
- Contact avec les excréments d’animaux sauvages

Contagion interhumaine
L’épidémie actuelle de monkeypox est due à la transmission interhumaine, puisque les zones géographiques éloignées et la simultanéité des cas excluent pratiquement que tous soient dus au passage zoonotique de l’agent.
Ce n’est pas une nouveauté, puisque depuis sa découverte il y a eu des rapports d’infections interhumaines. La chose la plus frappante est sans doute le nombre de patients qui composent la chaîne de transmission. On ne sait pas comment certaines personnes ont pu être infectées et certains de leurs contacts proches ne présentent aucun symptôme.
Dans les précédents rapports des années 1980 et 1990, la chaîne de transmission atteignait au plus 8 personnes. Cela signifie que pas plus que ce nombre de contacts étroits du cas zéro n’a pu être confirmé par le diagnostic.
Il s’agit d’un taux d’attaque très faible par rapport à d’autres pathologies similaires. Le taux d’attaque est une mesure épidémiologique permettant de déterminer le pourcentage des personnes les plus proches d’un patient pouvant être infectées.
Les taux d’attaque de la variole du singe atteignaient un maximum de 11 %. Si nous comparons ce taux à celui de la variole classique, les données sont insignifiantes : cette dernière a un taux d’attaque de 80 %.
Bien que l’on suppose que le contact étroit est la voie de transmission, on pense que la contagion interhumaine proviendrait de l’air et de la peau, des gouttelettes qui sortent avec le souffle et de la peau à la fourrure.
Comme pour la variole, les lésions cutanées et les liquides qui s’en échappent sont contagieux. Le virus peut voyager à travers les sécrétions.
Le faible taux d’attaque et le manque d’informations sur la chaîne de transmission de l’épidémie actuelle ne permettent pas de définir plus clairement les circonstances qui rendent la contagion effective. S’il s’agit d’une voie respiratoire commune (comme la grippe), pourquoi n’y a-t-il pas plus de contacts étroits de patients déjà confirmés infectés ?
La transmission sexuelle est aussi analysée dans l’épidémie actuelle. Il semble qu’il s’agisse d’un facteur commun chez les patients chez qui la chaîne d’infections s’est établie. Mais il n’y a aucune confirmation et certains spécialistes ne considèrent même pas cette voie comme une voie possible.
Quels sont les symptômes de la maladie ?
La période d’incubation du monkeypox, c’est-à-dire le délai entre le contact avec le virus et l’apparition des premiers symptômes, varie de 6 à 16 jours. Il n’y a pas de clarté à ce sujet, mais 2 semaines semblent être la moyenne.
Le tableau classique commence par de la fièvre qui peut durer entre 1 et 4 jours. Elle s’accompagne des symptômes classiques des symptômes fébriles, avec céphalées, fatigue, myalgies et somnolence.
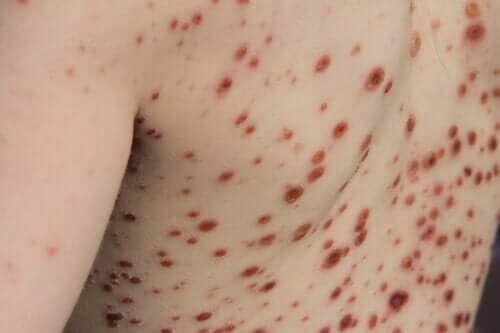
Ensuite, l’éruption cutanée caractéristique commence. Ce qui a été décrit jusqu’à présent est une présentation centrifuge (commence dans le tronc du corps et se poursuit vers les extrémités) de macules (taches) et de papules (peau surélevée), ainsi que de vésicules (contenant du liquide) et de pustules (contenant du pus ) qui se transforment en croûtes.
Les ganglions lymphatiques enflés sont prédominants dans le monkeypox. Cela la distingue de la variole classique, qui n’a presque pas d’adénopathies.
La sévérité du tableau clinique peut être légère (la plupart du temps) ou mortelle (seulement 1% est le taux de mortalité en Afrique). Les cas graves sont souvent compliqués de vomissements et de diarrhée, d’encéphalite et de pneumonie. Certains d’entre eux atteignent une septicémie et meurent d’une défaillance multiviscérale.
Il existe une réponse immunitaire réduite chez les patients, ce qui peut favoriser une surinfection par des bactéries. C’est l’une des explications des cas mortels aboutissant à un sepsis.
Chez les femmes enceintes, il existe une situation particulière, car elles ont un taux de mortalité et de complications plus élevé lorsqu’elles sont infectées par le monkeypox. De même, certains rapports ont confirmé qu’il existe une transmission verticale, c’est-à-dire de la mère au fœtus.
L’affaire suspecte
Tout au long de l’histoire, de 1970 à nos jours, différentes définitions d’un cas suspect de monkeypox ont été données. Ceci est fait pour identifier les patients et les isoler.
Chaque pays établit quels sont les signes avant-coureurs à consulter et à quelles caractéristiques les systèmes de santé doivent répondre. Mais en général, il est convenu qu’une personne est suspectée d’avoir la maladie lorsqu’elle a de la fièvre et une éruption cutanée de vésicules, accompagnée d’au moins 1 des 3 symptômes suivants :
- Éruption cutanée sur la paume des mains ou la plante des pieds.
- Gonflement des ganglions lymphatiques.
- Épisodes de température corporelle élevée avant l’apparition de l’éruption cutanée.
Bien sûr, à cela s’ajoute l’enquête pour savoir qui était avec le patient suspect. Si la personne présentant ces signes a été en contact étroit avec une personne dont le diagnostic est déjà confirmé, la possibilité d’être positif augmente.
Comment le diagnostic est-il confirmé ?
La première étape sur la voie du diagnostic de la variole du singe commence par la suspicion. Il s’agirait des cas suspects selon la définition que nous avons donnée précédemment.
Ces patients doivent être isolés et des tests doivent être lancés pour déterminer si la pathologie peut être confirmée ou non. Ce n’est pas une chose rapide, car ce n’est pas encore un agent viral largement disponible dans le monde entier pour les tests.
Dans plusieurs endroits, des tests d’immunoglobuline IgG et IgM contre Orthopoxvirus ont été demandés. Ce n’est pas quelque chose de précis, mais si le résultat est positif, cela permet d’avancer dans la confirmation, en attendant des résultats plus concrets qui pourraient prendre du temps.
Ces tests plus spécifiques sont au nombre de 3 et dépendent de la disponibilité dans chaque centre de santé :
- Réaction en chaîne par polymérase (PCR).
- Immunohistochimie.
- Microscopie électronique.
Ces méthodes ne sont généralement disponibles que dans certains centres qui reçoivent des échantillons d’autres zones géographiques. Dès lors, le délai est quasiment inéluctable et l’isolement des suspects doit être appliqué, en attendant.
Les immunoglobulines, la PCR et l’immunohistochimie nécessitent un échantillon de sang du patient. La microscopie électronique permet de faire une analyse visuelle des sécrétions si elles sont prélevées pour être envoyées au laboratoire.
Quel est le traitement de la variole du singe ?
Monkeypox n’a pas de traitement concret et spécifique. Comme de nombreuses pathologies virales, il n’existe pas de médicament particulier capable de bloquer ou d’annuler la réplication de l’agent pathogène.
Par conséquent, ce qui est préconisé est l’isolement avec des mesures de soutien. Il existe des patients présentant des symptômes légers qui ne nécessitent aucune approche pharmacologique. D’autres présentent une gravité qui justifie des tests avec des antiviraux.
Il n’y a pas suffisamment de preuves sur l’efficacité des antiviraux pour réduire les complications. Ils sont réservés à une utilisation à la discrétion de l’équipe soignante chez les personnes qui s’aggravent ou qui sont à risque de décès, c’est-à-dire chez 1 % des personnes diagnostiquées.
Brincidofovir et tecovirimat sont les noms de deux médicaments qui ont été étudiés pour le traitement des Orthopoxvirus. Il y a plus d’expérience avec eux dans le domaine de la variole classique, ils représentent donc aujourd’hui l’option disponible pour l’épidémie.
En revanche, les complications méritent leur propre schéma thérapeutique. Les surinfections bactériennes, fréquentes dans les cas graves, sont traitées avec des antibiotiques spécifiques à l’organisme identifié.
En cas de pneumonie ou d’encéphalite qui apparaît comme une complication lors de l’hospitalisation, l’équipe médicale peut décider d’assurer une assistance vitale. Ceci est réalisé avec une ventilation assistée, si les paramètres cliniques le justifient. Cela ne diffère pas beaucoup de ce qui se fait avec des affections similaires causées par d’autres étiologies.
La décharge médicale
Il y a encore des discussions sur le moment de décharger les patients. La plupart se rétablissent de manière satisfaisante et n’ont pas de séquelles. Mais la question de la contagion interhumaine est ce qui détermine le doute sur le moment de laisser sortir l’isolement.
Dans les foyers précédents, tant en Afrique que dans certains enregistrés aux États-Unis et au Royaume-Uni, la sortie était proposée lorsque les croûtes des patients disparaissaient. On suppose qu’à ce moment-là il n’y a pas de contagion. Comme avec la variole classique.
Cependant, chez certains patients, des résultats PCR positifs ont été retrouvés dans les voies respiratoires, jusqu’à 3 semaines après la disparition des croûtes. Il n’est pas confirmé si cela signifie contagiosité.
Nous savons également, grâce à des rapports antérieurs, qu’il y a des patients qui présentent à nouveau une lymphadénopathie et une éruption cutanée après avoir eu des rapports sexuels après leur sortie de l’hôpital. Cela fait suspecter une installation du virus dans la région génitale, ce qui pourrait prolonger la transmission par cette voie longtemps après.
Existe-t-il un vaccin ?
La Food and Drug Administration ( FDA) des États-Unis a approuvé un vaccin appelé JYNNEOS en 2019. Cette immunisation serait efficace contre la variole et le monkeypox.
Il n’a pas été déterminé qu’il soit disponible pour le marketing de masse, bien que l’indication pour les populations à risque soit à l’étude. Les personnes vivant dans des zones endémiques, les contacts étroits de cas confirmés et les travailleurs exposés à des animaux connus pour être des réservoirs pourraient être des receveurs.
Le plan de vaccination avec ce flacon est de 2 doses qui doivent être espacées de 1 mois. Mais nous soulignons qu’il n’y a toujours pas d’approbation pour son inclusion dans les calendriers officiels ou pour l’appliquer dans les circonstances de cette épidémie actuelle. Bien que les pays de l’Union européenne travaillent sur les questions juridiques pour acquérir des doses et les placer dans des contacts étroits, en supposant que cela pourrait générer une protection pour arrêter la propagation dans les groupes exposés.
On sait que les personnes vaccinées avec le vaccin classique contre la variole ont un avantage. La protection offerte par une telle immunisation contre la variole du singe est estimée à 85 %, ce qui est considéré comme plus qu’acceptable.
En effet, une partie du caractère unique de cette épidémie actuelle est qu’il y a moins de personnes vaccinées contre la variole en raison des zones géographiques qui ont été déclarées éradiquées. Cela aurait accru la sensibilité des populations aux virus d’une même famille.
L’épidémie actuelle : ce que l’on sait
On considère que l’épidémie actuelle de monkeypox a commencé le 7 mai 2022, lorsque le Royaume-Uni a signalé un cas en dehors de l’Afrique. Malgré cela, certains épidémiologistes proposent de prolonger la période à partir de l’année 2021, lorsque les États-Unis ont enregistré une petite série de cas sur leur territoire.
Depuis début mai jusqu’à présent, il y a plus de 250 cas confirmés en dehors de l’Afrique. Ce qui implique 16 pays.
C’est une situation inédite, surtout avec les plus de 100 suspects qui sont isolés, en attente de confirmation. L’Organisation mondiale de la santé a déclaré l’épidémie, mais précise qu’il existe une possibilité de la contrôler. De plus, le risque pour la population générale est faible.
En Espagne, il y a 84 cas confirmés, l’Irlande du Nord a eu son premier patient positif le 26 mai, tout comme le Pays de Galles. L’Australie a enregistré le premier à Melbourne, chez une personne revenant du Royaume-Uni.
Le cas du Massachusetts venu de Montréal a déclenché une recherche intensive de suspects au Canada, où 13 personnes ont été isolées. Dans le même temps, les États-Unis ont relevé la recommandation d’alerte pour les voyages internationaux, afin que des précautions soient prises pour éviter la contagion interhumaine.
Que pouvons-nous faire ?
Les mesures de prévention pour éviter de contracter la variole du singe concernent certaines directives générales et restrictions qui doivent être appliquées dans des circonstances spécifiques. Parmi les premiers on peut citer les suivants :
- Lavage fréquent des mains.
- Manipulez les aliments d’origine animale avec un maximum de mesures sanitaires.
- N’achetez des produits alimentaires d’origine animale que dans les lieux et établissements autorisés.
- Lors de vos déplacements, restez dans des lieux certifiés par les autorités sanitaires et où les contrôles antiparasitaires effectués dans les chambres sont exposés.
- Si vous visitez des réserves naturelles, telles que des parcs à thème ou des zoos, n’entrez pas en contact avec des animaux et gardez une distance de sécurité avec eux.
En ce qui concerne les restrictions particulières, il convient de souligner que le contact au cours des 14 à 21 derniers jours avec des personnes malades ou le fait d’avoir voyagé dans une zone géographique où sévit une épidémie implique la consultation des autorités sanitaires. L’isolement et le dépistage avec des méthodes complémentaires doivent être effectués.
L’auto-isolement jusqu’à la consultation devrait être une norme pour les personnes qui répondent à ces caractéristiques. De même, les membres de la famille et les partenaires doivent suivre la même procédure jusqu’à ce qu’il y ait une confirmation positive ou négative.
Il est important de ne pas paniquer. Comme l’OMS l’a précisé, nous ne sommes pas encore confrontés à une situation de pandémie, et il n’y a pas non plus de risque accru pour la population générale, donc des mesures d’hygiène générales suffisent, en identifiant les symptômes tôt et en consultant en cas de doute.
Toutes les sources citées ont été examinées en profondeur par notre équipe pour garantir leur qualité, leur fiabilité, leur actualité et leur validité. La bibliographie de cet article a été considérée comme fiable et précise sur le plan académique ou scientifique
- Marennikova SS, Seluhina EM, Malceva NM, Ladnyj ID. Poxviruses isolated from clinically ill and asymptomalically infected monkeys and a chimpanzee. Bulletin of the World Health Organization. 1972;46(5):613–20. pmid:4340220.
- Doty JB, Malekani JM, Kalemba LN, Stanley WT, Monroe BP, Nakazawa YU, et al. Assessing Monkeypox Virus Prevalence in Small Mammals at the Human-Animal Interface in the Democratic Republic of the Congo. Viruses. 2017;9(10):03. pmid:28972544.
- Ogoina D, Iroezindu M, James HI, Oladokun R, Yinka-Ogunleye A, Wakama P, Otike-Odibi B, Usman LM, Obazee E, Aruna O, Ihekweazu C. Clinical course and outcome of human monkeypox in Nigeria. Clinical Infectious Diseases. 2020 Oct 15;71(8):e210-4.
- Coto, C. E. (2009). Virus sin fronteras: el caso del virus cow pox, agente de la viruela bovina. Química Viva, 8(2), 57-63.
- Reynolds MG, Carroll DS, Olson VA, Hughes C, Galley J, Likos A, et al. A silent enzootic of an orthopoxvirus in Ghana, West Africa: Evidence for multi-species involvement in the absence of widespread human disease. American Journal of Tropical Medicine and Hygiene. 2010;82(4):746–54. pmid:20348530
- Mbala PK, Huggins JW, Riu-Rovira T, Ahuka SM, Mulembakani P, Rimoin AW, et al. Maternal and Fetal Outcomes among Pregnant Women with Human Monkeypox Infection in the Democratic Republic of Congo. Journal of Infectious Diseases. 2017;216(7):824–8. pmid:29029147.
- Jezek Z, Grab B, Szczeniowski M, Paluku KM, Mutombo M. Clinico-epidemiological features of monkeypox patients with an animal or human source of infection. Bulletin of the World Health Organization. 1988;66(4):459–64. pmid:2844428
- Nolen LD, Osadebe L, Katomba J, Likofata J, Mukadi D, Monroe B, Doty J, Hughes CM, Kabamba J, Malekani J, Bomponda PL, Lokota JI, Balilo MP, Likafi T, Lushima RS, Ilunga BK, Nkawa F, Pukuta E, Karhemere S, Tamfum JJ, Nguete B, Wemakoy EO, McCollum AM, Reynolds MG. Extended Human-to-Human Transmission during a Monkeypox Outbreak in the Democratic Republic of the Congo. Emerg Infect Dis. 2016 Jun;22(6):1014-21. doi: 10.3201/eid2206.150579. Erratum in: Emerg Infect Dis. 2016 Oct;22(10 ): PMID: 27191380; PMCID: PMC4880088.
- Reynolds, M. G., Yorita, K. L., Kuehnert, M. J., Davidson, W. B., Huhn, G. D., Holman, R. C., & Damon, I. K. (2006). Clinical manifestations of human monkeypox influenced by route of infection. The Journal of infectious diseases, 194(6), 773-780.
- Mwanbal, P. T., Tshioko, K. F., Moudi, A., Mukinda, V., Mwema, G. N., Messinger, D., … & Esposito, J. J. (1997). Casos humanos de viruela de los monos en Kasai Oriental, Zaire (1996-1997). Eurosurveillance, 2(5), 33-35.
- Chittick G, Morrison M, Brundage T, Nichols WG. Short-term clinical safety profile of brincidofovir: A favorable benefit–risk proposition in the treatment of smallpox. Antiviral research. 2017 Jul 1;143:269-77.
- Grosenbach DW, Honeychurch K, Rose EA, Chinsangaram J, Frimm A, Maiti B, Lovejoy C, Meara I, Long P, Hruby DE. Oral tecovirimat for the treatment of smallpox. New England Journal of Medicine. 2018 Jul 5;379(1):44-53.
- Reynolds MG, Davidson WB, Curns AT, Conover CS, Huhn G, Davis JP, et al. Spectrum of infection and risk factors for human monkeypox, United States, 2003. Emerging Infectious Diseases. 2007;13(9):1332–9. pmid:18252104.
- Panning M, Asper M, Kramme S, Schmitz H, Drosten C. Rapid detection and differentiation of human pathogenic orthopox viruses by a fluorescence resonance energy transfer real-time PCR assay. Clinical Chemistry. 2004;50(4):702–8. pmid:14962998.
Ce texte est fourni à des fins d'information uniquement et ne remplace pas la consultation d'un professionnel. En cas de doute, consultez votre spécialiste.








